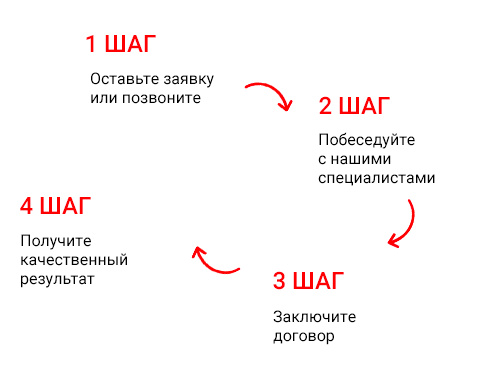
ЭКСПОРТ МЕДИЦИНСКИХ ИЗДЕЛИЙ НА РЫНОК АМЕРИКИ

ТРЕБОВАНИЯ РЕГЛАМЕНТА QS
FDA 21 CFR Часть 820 не содержит подробного описания того, как должно производиться то или иное устройство, а аккумулирует передовой опыт по созданию и ведению эффективной СМК и требования для производства безопасной и качественной медицинской продукции.
FDA QSR предъявляет следующие требования к:
1. системе качества
Производители должны создать и поддерживать систему качества, отвечающую правилам настоящего Регламента США
2. проектированию
Внедрить методы и процедуры, обеспечивающие соответствие всего процесса проектирования: от разработки технического задания до передачи проекта в производство и управления изменениями файла проектирования
3. документации
Назначение ответственных(-ого) лиц(-а), ведение документации и технического файла (device master record) в электронном или письменном виде
4. закупкам
Оценка поставщиков, подрядчиков и других заинтересованных сторон, например, консультантов
5. производству и технологическому процессу
Необходимо контролировать и документально подтверждать, что производственная среда, технологический процесс, оборудование, квалификация персонала и др. ключевые факторы соответствуют всем надлежащим правилам изготовления готовой продукции установленного качества. Для этого необходимо проводить валидацию всех процессов, а для стерильных изделий – еще и валидацию процедуры создания стерильного барьера, включая чистые помещения
6. корректирующим и предупреждающим действиям – CAPA (англ. corrective and preventive actions):
- сбор и анализ информации
- выявление несоответствий и установление их корневой причины (root cause)
- разработка плана и внедрение изменений
- оценка эффективности предпринятых действий
- документирование всех вышеперечисленных пунктов
7. идентификации и прослеживаемости
Требуется внедрение системы прослеживаемости и досье (device history record) используемого сырья, материалов, полуфабрикатов и технологических операций, а каждому готовому устройству, партии – уникальный штрих-код (UDI) для обеспечения мониторинга в течение всего жизненного цикла
8. маркировке и упаковке
9. хранению и распространению