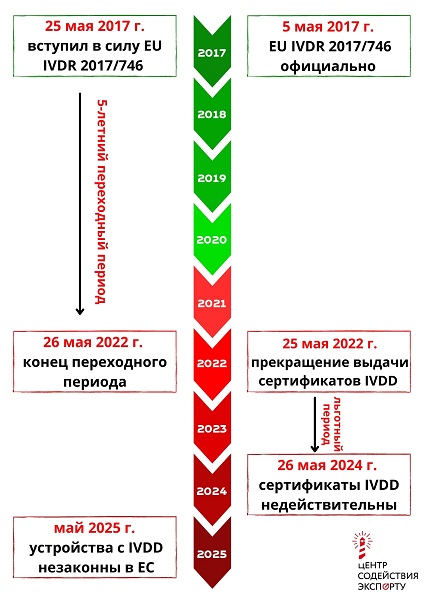
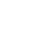ГРАФИК ПЕРЕХОДА С IVDD НА IVDR:
ЧТО ДЕЛАЕМ МЫ?
1. Оценка Вашей деятельности:
- классификация IVD в соответствии с Приложением VIII Регламента IVDR
- изучение Вашей системы менеджмента качества (СМК) и технической документации на предмет соответствия новым правилам
- помощь в устранении недочетов
2. Разработка плана перехода на IVDR:
- проверим все даты истечения срока действия Вашего сертификата/декларации (CE маркировка) и дадим рекомендации о целесообразности продления старого документа или получения нового
- помощь с выбором сертифицирующего органа и взаимодействие с ним
3. Помощь со сведением всех новых и старых данных в один технический файл согласно требованиям IVDR
4. Сопровождение сертификации вплоть до выдачи сертификата или декларации Вам на руки
Дополнительные услуги:
- Разработка и внедрение системы менеджмента качества ISO 13485
- Различные семинары онлайн или оффлайн по обучению IVDR, при необходимости и MDR
Остались вопросы? Заполните заявку и мы свяжемся с вами в течение 15 минут!